La colorazione di Papanicolaou, usata in citologia è utile soprattutto per lo studio delle cellule epiteliali, infatti è per gli strisci cervico-vaginali che George Papanicolaou introdusse questa colorazione (Pap test). La colorazione di Papanicolau è una colorazione di tipo tricromica
Applicazioni
- Campioni ginecologici
- Espettorato
- Urina
- Agoaspirati, (FNAB, fine needleaspiration biopsy agobiopsia con ago sottile) da organi diversi
- Essudati
- Lavaggi.
Risultati
- Citoplasma:
- Cianofilo (basofilo) Blu; verde intenso
- Eosinofilo (acidofilo) Rosa
- Cheratinizzato Rosa arancio
- Eritrociti: Rosso
- Nuclei: Blu nero; violetto scuro
Principio della colorazione di Papanicolaou
Come detto la colorazione di Papanicolaou è di tipo multicromica ed è basata sull’utilizzo di più coloranti
- Ematossilina
- Orange G
- Eosina
- Verde Luce
in 3 soluzioni.
- colorazione nucleare (ematossilina)
- OG-6 (Orange G)
- EA (Eosina e Verde Luce)
L’Ematossilina è il colorante nucleare
OG6 conferisce al citoplasma una colorazione dall’arancio brillante al giallo
L’eosina invece conferisce al citoplasma delle cellule pavimentose mature e superficiali una colorazione rosa; questa colorazione mette in risalto il carattere eosinofilo delle cellule cheratinizzate.
Il Verde Luce colora il citoplasma delle cellule basali e parabasali (cianofile), povere di cheratina e conferisce una colorazione verde-celeste.
La colorazione di Papanicolaou fornisce ottimi dettagli e contrasti cromatici della struttura nucleare. In oltre questa colorazione garantisce una sufficiente trasparenza del citoplasma e delle peculiari tonalità cromatiche tipiche degli stadi cellulari siano essi fisiologici e patologici(compresi gli inclusi)
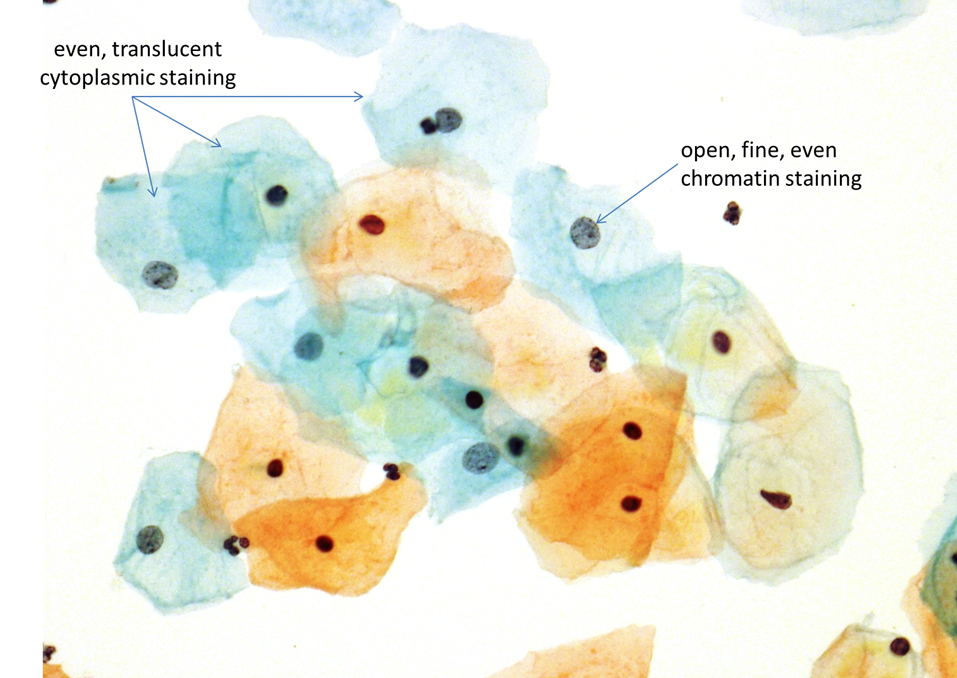
Tutto ciò permette uno studio importante delle condizioni neoplastiche e flogistiche, anche associate a batteri e virus (HPV) .
PRO
Questa colorazione permette di apprezzare la fase di maturazione delle cellule, di identificare alterazioni dovute ad infezioni batteriche o virali e di valutare la predisposizione allo sviluppo del cancro.
CONTRO
La colorazione di Papanicolaou può avere procedure lunghe e complesse, ed è per ovviare a questo che sono state sviluppate formulazioni fast che hanno tempi e modi di lavoro più semplici; questo comporta una maggiore fruibilità della colorazione e un ausilio in diagnostica. Resta di fondamentale importanza la preparazione del citologo
Richiedi un campione
colorazione rapida con alcool (tempo min 2:30″ max 4 min.)
Metodo
- Immergere rapidamente 10-15 volte in soluzione fisiologica per un secondo i vetrini, precedentemente fissati all’aria.
- Passare rapidamente in immersione per 10-15 volte in alcool 96°
- immergere il vetrino nella suluzione 1 per 30-60 sec.
- sciacquare per 10 sec con acqua di fonte
- immergere per 20-30″ in Blue water
- sciacquare con 6 rapidi passaggi in acqua di fonte
- 8-10 immersioni rapide in alcool a 96°
- immergere il vetrino nella suluzione 2 per 30-60 sec.
- immergere rapidamente 10-15 volte in alcool 96°
colorazione rapida senza alcool
Metodo
- Vetrini fissati all’aria passaggio uno
- Colorare i nuclei con ematossilina per 2-5 minuti.
- Risciacquare rapidamente con acqua distillata.
- Acqua di Scott (blu water), 3-5 minuti.
- Risciacquare con acqua distillata.
- Golding soluzione di colorazione per 2-5 minuti.
- Risciacquare rapidamente con acqua distillata.
- Disidratare rapidamente con etanolo.
A questo link potete trovare informazioni per chi vuole approfondire

