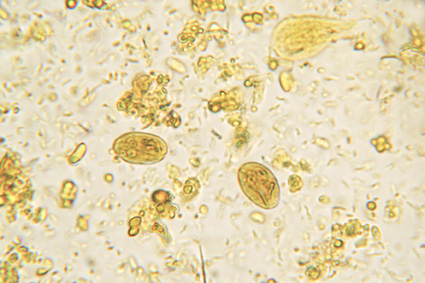
La flottazione fecale consiste sostanzialmente in un processo di arricchimento del campione. Questo arricchimento sarà sensibilmente migliorato da un processo di centrifugazione.
La scelta della soluzione flottante è determinata dal tipo di parassita che vogliamo isolare. Le soluzioni sono molteplici, qui prenderemo in considerazione le più usate.
Soluzioni flottanti di uso comune
- Nitrato di sodio o cloruro di sodio è utile nell’identificazione delle uova di elminti ma scarsamente utile per l’identificazione dei protozoi eccezion fatta per le cisti di coccidi. Occasionalmente con l’uso di questa soluzione si possono osservare trofozoiti di Giardia che normalmente potrebbero essere lisati in questa soluzione.
- Solfato di zinco è la soluzione flottante ad alto PS più utilizzata e particolarmente indicata per l’isolamento di larve di strongili e per gli altri parassiti. Sconsiglio il Solfato di Zinco perché costoso e di non facile reperibilità, inquinante e può alterare la struttura dei parassiti a causa dell’elevata pressione osmotica della soluzione.
- Soluzione zuccherina di Sheather presenta le stesse caratteristiche in termini di peso specifico ma è più viscosa, caratteristica che non permette ai detriti di salire in superficie favorendo la lettura del campione (e in alcuni esami delle feci questo non è un dettaglio da poco)
E’ inoltre totalmente biodegradabile (fatta eccezione per un piccolo quantitativo di formalina)
Ha una bassa pressione osmotica rispetto alle soluzioni ad alto peso specifico, lasciando inalterate le strutture dei parassiti
Di facile preparazione anche in ambulatorio.
E’ particolarmente indicata per l’isolamento di protozoi e anche di larve di strongili e uova di parassiti.
Procedura di flottazione
- In una provetta falcon si introducono 8-10 ml di acqua e 1-2 grammi di feci
- Mescolare bene e porre la provetta in centrifuga a 1500 g per 5 minuti gettare via il surnatante, rovesciando la provetta. (ripetendo più volte questa operazione di centrifuga con acqua si otterranno feci più chiare)
- Aggiungere 7-8 ml di soluzione flottante
- Miscelare bene
- Centrifugare a 1500 g per 5 minuti
- Aspirare con una pipetta una piccola parte di surnatante (una goccia o poco più) in prossimità del contatto del liquido con la parete della provetta e apporla su di un vetrino.
- Coprire con vetrino copri oggetto e osservare

La provetta Falcon è particolarmente indicata per la parassitologia, in quanto nel fondo conico si raccoglie il sedimento e il fatto che sia graduata aiuta nell’aggiunta delle soluzioni.
Secondo la mia esperienza una flottazione con centrifugazione può rendere positivo, anche se debolmente, un campione che con flottazione in soluzione salina semplice risulterebbe negativo. L’uso di soluzioni flottanti con peso specifico superiore alla salina, in fase di centrifugazione, può svelare una concentrazione fecale del parassita fino a 50 volte superiore ad una flottazione tradizionale .
Uso del miflotac
Per implementare la sensibilità della procedura di arricchimento e la velocità di esecuzione consiglio l’utilizzo del mini flotac. Il flotac è stato concepito ed è acquistabile presso l’Università di medicina Veterinaria di Napoli, naturalmente anche on line.

Risulta costituito da un fill flotac sulla sinistra, che funge da omogenizzatore, in questo andremo ad introdurre le feci e l’acqua. Una volta omogenizzate si verserà il contenuto in due falcon (10 ml circa in ogni provetta). A questo punto si procederà come descritto su, nella procedura di flottazione con centrifuga:
- In una provetta falcon si introducono 8-10 ml di acqua e 1-2 grammi di feci
- Mescolare bene e porre la provetta in centrifuga a 1500 g per 5 minuti gettare via il surnatante, rovesciando la provetta. (ripetendo più volte questa operazione di centrifuga con acqua si otterranno feci più chiare)
- Aggiungere 7-8 ml di soluzione flottante
- Miscelare bene
- Centrifugare a 1500 g per 5 minuti
- Aspirare con una pipetta una piccola parte di surnatante (circa 2 ml) in prossimità del contatto del liquido con la parete della provetta e apporla nel pozzetto di lettura del mini flotac.
- una volta depositato il contenuto si possono aspettare altri 10 min. di flottazione semplice oppure procedere con la traslazione del coperchio e procedere alla lettura
Sito suggerito dotato di molte immagini ottimo per lo studio.